老年性黄斑变性(AMD)是由多种因素诱发并与年龄相关的一组黄斑疾病,其共同特点是黄斑部视网膜病变,亦称年龄相关性黄斑变性或衰老性黄斑变性。
AMD特点:
► 导致中心视力丧失
► 多始发于50岁上下,年龄越大,患病率越高
► 双眼同时或先后受害
► 其发病与视网膜色素上皮细胞的代谢功能衰退有关
► 不可治愈性盲
发病率高:根据1989年、1992年和1994年3次流行病学调查结果显示:50-59岁老年性黄斑变性的发病率是3.66-5.50%,60-69岁的发病率为6.04-11.19%,其根据年龄的增长而增长。
了解视网膜
• 视网膜又称外周脑,与部分脑组织的发展相关
• 体内新陈代谢最活跃的组织
• 体内单位体积耗氧量最高
• 体内单位体积Omega-3脂肪酸浓度最高——超过大脑
黄斑:是视网膜后极部的一中央无血管的凹陷区,直径约2mm,为浅漏斗状,该区富含叶黄素。黄斑处视网膜最薄,只有视锥细胞,主管视力和色觉功能,光线到达黄斑时能直接照射到视锥细胞上,所以黄斑是中心视力最敏锐之处。黄斑一旦发生病变就会出现明显的视力减退甚至失明。
视网膜疾病诱发因素
• 炎症
• 氧化压力
• 免疫系统失衡
• 感光细胞死亡
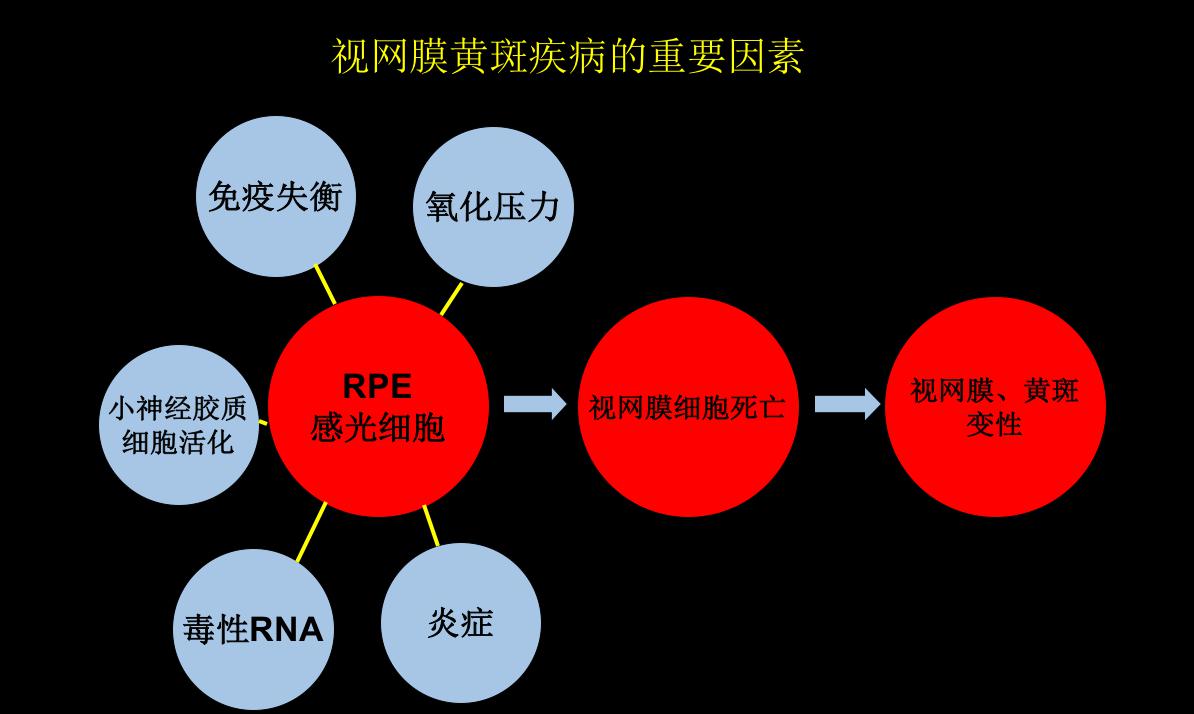
图1视网膜黄斑疾病的重要因素
黄斑变性是一种慢性眼病,它能引起中心视力的急剧下降,而中心视力是日常活动所必需的,如阅读、看时间、识别面部特征和驾驶等。它是不可逆的中心视力的下降或丧失,很难再治愈。老年性黄斑变性多发生在45岁以上,年龄越大,发病率就越高。发病率有种族差异,白种人的发病率高于有色人种。
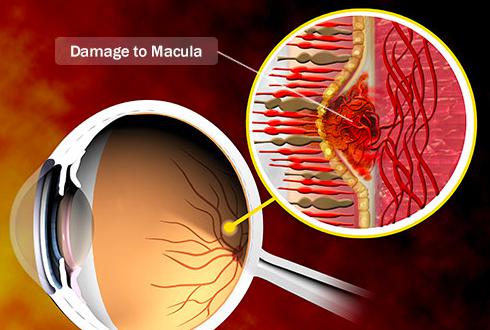

图2 黄斑变性的中心视力改变
危险因素
一、脑血管疾病与老年黄斑变性(AMD)
1.高血压和体重指数(BMI)
高血压与AMD的关系还存在一定的争议。来自妇女健康主动视力检查辅助研究(WHISE)数据显示,AMD与增高的收缩压有关【1】。美国年龄相关性眼部疾病研究(AREDS)发现舒张压、高血压患病史和使用抗高血压药物与湿性AMD之间的关联【2】。一些大型研究提示AMD的发生与升高的BMI之间存在关联【3,4】。随着女性腰臀比或BMI的增加,发生早期或晚期AMD风险也会随之增加【1】。
2.胆固醇水平
使用他汀可以减少AMD患者新生血管化的风险【5】。目前最新的队列研究显示,使用他汀的患者发展成为软玻璃膜疣的风险有所降低,并且发展为晚期AMD前期病变的风险也降低【6】。但最近另有研究显示,他汀的使用对AMD的进展,以及早、晚期AMD五年发病率均没有影响【7】。尽管对于他汀和AMD的关系做了很多的大型流行病学研究,但是到目前为止还没有进行过临床随机对照试验(RCTs)。因此,对于他汀是否对AMD有保护性作用,目前还不是很清楚。
3.动脉硬化
人们一直怀疑动脉粥样硬化与AMD发生有一定关联,主要原因是动脉粥样硬化影响脉络膜血液循环,脂类易沉积在脉络膜组织。一些研究结果认为动脉硬化症或颈动脉粥样硬化斑块与AMD有关联【8】。其他亚临床动脉粥样硬化指征,如腹主动脉钙化灶存在等,也与AMD发生率增高明显相关【9】。
二、环境因素
1.吸烟
吸烟是AMD最重要的而且是最可能改变的危险因素【10】。最近美国一项双生子研究在681对成年双生子中进行吸烟、饮食与AMD的研究,结果表明,现在吸烟者与过去曾吸烟者患 AMD的风险分别是不吸烟者的1.7和1.9倍【11】。研究显示,现在吸烟者患晚期AMD的风险是从不吸烟者的3.9倍,过去曾吸烟者患地图样萎缩的风险是从不吸烟者的3.4倍【12】。近期的研究发现,吸烟与某些AMD的遗传易感因素有联合作用。LOC387715和补体因子H(CFH)是AMD的两个主要易感基因,吸烟能够使这两个易感基因的效应加倍【13】。由于吸烟是可改变的环境因素中的为数不多的研究结论一致且可以确定的危险因素,因此,建议有AMD体征的患者应该戒烟。
2.饮食习惯
(1)脂肪酸摄入与AMD:多项研究显示总脂肪、饱和脂肪和植物性脂肪的摄入均与进展型AMD有关,并提示每周摄入鱼类可以降低AMD的发生率【11,14】。AREDS最新的研究结果表明,Omega-3不饱和脂肪酸(LCPUFAs)与鱼类的摄入是新生血管性AMD的保护因素,而食物中花生四烯酸的摄入则会增加新生血管性AMD发病风险【15】。目前可以明确的是,包含在动物性脂肪以及某些植物性脂肪中的饱和脂肪会升高胆固醇水平,因而有可能进一步与AMD的发病相关联。因此,限制饱和脂肪的摄入目前在很多国家是被推荐的。
(2)抗氧化剂与AMD:抗氧化剂如类胡萝卜素、叶黄素和玉米黄素,高度集中于黄斑区,可能在AMD的发展中起到一定的延缓作用【16】。这种黄斑色素确切的保护机制还不确定,可能是减轻由蓝光吸收所引起的光氧化作用,并由于其抗氧化剂作用,保护光化学作用的副反应【17】。目前对于抗氧化剂与AMD的关系已有大量研究,但结果很不一致。2007年一项Meta分析对一些抗氧化剂与AMD的关系进行了汇总,均未显示抗氧化剂补充疗法对AMD预防有效【16】。而2007年美国AREDS最新一项病例对照研究结果表明,食物中的叶黄素和/或玉米黄质对新生血管性AMD、地图样萎缩以及大的中央玻璃膜疣有保护作用【18】。
三、细胞因子和载脂蛋白
虽然AMD的发病机制尚不明确,但是,人群对外来环境因素的不同的遗传易感性是建立在不同的遗传背景上的。除了光感受器特异性ATP结合转运子基因(ABCR基因)、二型囊样黄斑变性基因(VMD2基因)、金属蛋白酶3组织抑制因子基因(TIMP3基因)、缓慢型视网膜变性基因(RDS基因)等AMD的候选基因,最近研究热点集中在一些新的与AMD发病风险相关的遗传标记物。
1.补体因子H(CHF)
CHF是存在于正常血清中的补体调节蛋白之一,是旁路途径活化和放大效应的主要抑制因子。已有研究证明,CHF基因的多态性,即CFH Y402H(rsl061170,1277T®C),与人体对AMD的易感性有关【19-21】。最近的一项Meta分析纳入5451个病例和3540个对照,结果显示杂合子的比值比(OR)为2.42, 纯合子OR值为6.22【22】。这种特定的关联分别在多个国家的研究人群中得到证实【23】。最近的一些研究还显示,Y402H并不是CFH基因内唯一的AMD相关标记物【24.25】。一项研究发现了在rsl410996的第二个与AMD相关联的位点,这个单核苷酸多态性(SNP)位点位于CFH基因内含子区域,与AMD的关联,比Y402H还要强【25】。另一项研究发现了由5个SNP组成的8个主要单体型,其中有两个有保护作用,其余的6个与AMD的发病风险增高相关【24】。
上述一系列研究结果为AMD发病机制中的“免疫学说”提供了遗传学证据。然而事实上,与AMD相关的CFH的SNP的功能意义目前还不清楚。Li等【24】,Maller等【25】认为可能是某些变异影响了CHF的表达,或受到临近的功能相似基因影响而与AMD产生关联。
2.补体因子B(BF)和补体成分2(C2)
进一步研究显示,补体系统在AMD中发挥作用。BF或C2区域中的保护性或高风险的单体型【25,26】。C2和BF在补体系统激活通路中起到了至关重要的作用。有研究显示,C2/BF位点最常见的单体型H1使AMD的发病风险升高;由四个变异组成的两个单体型H7和H10则产生了保护性作用。H10单体型中的rs641153是真正的易感性SNP。C2上的SNP并没有显示出生物学功能,BF上的SNPs可能功能性地影响了BF的活性并调节BF的分泌【26】。
3.Pleckstrin同源结构域A家族成员1基因(PLEKHA-1)/AMD易感基因2(ARMS2)/丝氨酸肽酶1(HtrAl):吸烟和肥胖可以促进基因的表达。
连锁研究提示染色体10q26与AMD相关【27】。由于在PLEKHAl和ARMS2周围出现非常强的关联信号,所以这两个基因的SNPs是被研究的最彻底的【28】。Maller等【25】认为真正的AMD易感SNP是ARMS2的S69A多态性 (rsl0490924),并且与S69A处于强连锁不平衡的SNP存在于HtrAl。最近有两项研究报告了HtrAl(rsll200638)调节区域的一个变异,这个变异可能是在PIEKHAl/ARMS2/HtrAl 发现的强关联信号的真正来源【29.30】。
几乎在全世界范围内都认为PLEKHA-1/ARMS2/HtrAl位点是与AMD相关的。研究显示有HtrAl变异的AMD患者存在新生血管化。当仅考虑脉络膜新生血管化或地图样萎缩的严重AMD患者时,这种关联就更强【22,25,28,31-33】。
目前研究关注于PLEKHA-1/ARMS2/HtrA1区域和其他遗传以及环境因子的交互作用。吸烟和PLEKHA-1/ARMS2/HtrA1区域的交互作用目前还不清楚。有研究显示,在不吸烟的个体中,CFH和PLEKHA-1/ARMS2/HtrA1风险等位基因的纯合子其OR值为10.21(CI:3.27-31.94),而在吸烟的个体中,OR值则为31.51(C,:11.87—100.32)【31】。当吸烟、BMI≥25,以及两种风险基因型都存在时,患AMD的风险将增加19倍之多【32】。
4.血管内皮生长因子(VEGF)
VEGF是促进血管增生效力最强的因子之一,它可直接或间接地参与血管新生的每个过程。研究显示,VEGF在脉络膜视网膜血管生成中起重要作用。运用特异的反义寡聚核苷酸、VEGF中和抗体或可溶性受体抑制VEGF活性。能抑制视网膜下新生血管的形成,因此被认为与AMD发病机制相关,尤其是新生血管化【34】。目前,VEGF抑制剂已被应用于治疗AMD。
5.载脂蛋白E(APOE)
APOE是中枢神经系统重要的载脂蛋白和代偿突触形成过程中胆固醇和脂类转运的重要调节因子,其直接参与神经系统脂质的再分配和胆固醇代谢平衡【35】。APOE具有明显的基因遗传多态性,人类APOE基因定位于19q13.226,含有4个外显子和3个内含子,构成具有多态性。最常见的APOE等位基因是e2、e3和e4【35】。Baird等【36】通过AMD病例对照研究发现APOE多态性与AMD的发病明显相关。APOE e4等位基因频率在AMD患者中较对照组低,被认为是AMD的保护因子,或者至少延迟了发病年龄。而APOE e2等位基因则与提早发病有关 。
目前普遍认为AMD是一种多因素疾病,是多种环境与遗传因素相互作用的结果。减少或消除与AMD相关的环境与行为因素,采用对AMD相关的遗传标记物进行测量,识别高危人群,预测进展型AMD,进行早期干预将会得到较好的结果。
病理机制
主要为黄斑区结构的衰老性改变。表现为视网膜色素上皮细胞对视细胞外界盘膜吞噬消化功能下降,使未被消化的盘膜残余小体潴留于基底部细胞原桨中,并向细胞外排出,形成玻璃膜疣,因此继发病理改变后,导致黄斑变性发生,总之主要与黄斑区长期慢性光损伤,脉络膜血管硬化,视网膜色素上皮细胞老化有关。
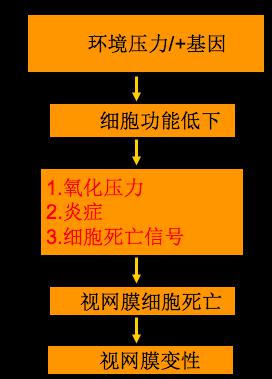
图3 黄斑变性的病理机制
分型
本病根据临床表现不同分为萎缩型和渗出型两种:
1.萎缩型—又称干性或非渗出性:主要为脉络膜毛细血管萎缩,玻璃膜增厚和视网膜色素上皮萎缩引起的黄斑区萎缩变性。
2. 渗出型—又称湿性或盘状黄斑变性:主要为玻璃膜的破坏,脉络膜血管侵入视网膜下构成脉络膜新生血管,发生黄斑区视网膜色素上皮下或神经上皮下浆液性或出血性的盘状脱离,最终成为机化瘢痕,据临床观察萎缩型也可转变为渗出型。
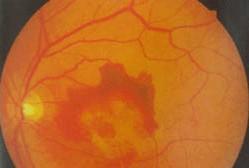
图4 干性黄斑变性VS.湿性黄斑变性
自我检测法
可用以下方法自我检测:用一只手遮住一只眼。另一只眼凝视远方景物,检查各眼视力是不是比以前下降了,例如看有线条、栅格的窗框或其他有线条、四方格的器皿,否有线条变弯、方格变小或变形等等。另外,还要注意久远有无黑影遮挡。一旦觉察视力逐渐降落,线条变弯、方格变形或变小,久远有活动黑影等异常情况,就应尽快及时到医院就诊。

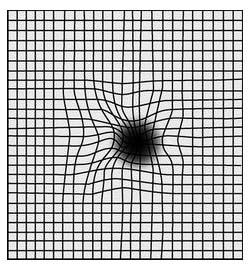
图5 正常VS.黄斑变性
未完待续,请继续关注:功能医学思维指导下老年性黄斑变性预防与干预(下)——功能医学干预措施
参考文献:
[1] Klein R,Deng Y,Klein BE,et al.Cardiovascular disease,its risk factors and treatment, and age-related macular degeneration: women’s health initiative sight exam ancillary study.Am J Ophthalmol,2007.143:473-483.
[2] Hyman L, Schachat AP, He Q, et al. Hypenension, cardiovascular disease, and age-related macular degeneration.Arch 0phthalmol,2000,118:351-358.
[3] Clemons TE,Milton RC,Klein R,et al. Risk factors for the incidence of advanced age-related macular degeneration in the Age-related eye disease study (AREDS) report No.1 9.Ophthalmology,2005,112:533—539.
[4] Seddon JM,George s,Rosner B,et al. CFH gene variant,Y402H, and smoking, body mass index, environmental associations with advanced age-related macular degeneration.Hum Hered,2006,61:157—165.
[5] Wilson HL,Schwartz DM,Bhatt HR,et al.Statin and aspirin therapy are associated with decreased rates of choroidal neovascularization among patients with age-related macular degeneration.Am J Ophthalmol,2004,137:615-624.
[6] Tan Js,Mitchell P,Rochtc hina E,et al.Statins and the long-term risk of incident age related macular degeneration: the bIue mountains eye study.Am J 0phthalmol,2007,143:685-687.
[7] Klein R,Knudtson MD,Klein BE.Statin use and the five-year incidence and progression of age-related macular degeneration.Am J Ophthalmol,2007,144:1-6.
[8] Tan Js,Mitchell P,Smith W, et al.Cardiovascular risk factors and the long-term incidence of age-related macular degeneration:the bIue mountains eye study. Ophthalmology, 2007, 114:1143-1150.
[9] Van Leeuwen R, Ikram MK, vingerling JR, et al. Blood pressure, atheroscIerosis, and the incidence of age-related maculopathy:the Rotterdam study.Invest Ophthalmol Vis Sci,2003,44:3771-3777.
[10] 侯慧嫒,王痢生。吸烟与年龄相关性黄斑变性.国际眼科纵览,2007, 31:330-333.
[11] Seddon JM,George S,Rosner B.Cigarette smoking,fish consumption.omega-3 fatty acid intake,and associations with age-reIated macular degeneration: the US twin study of age-related macular degeneration. Arch ophthalmol, 2006, 124:995一1001.
[12] Tan Js,Mitchell P,Kifley A,et al. Smoking and the long-term incidence of age-related macular degeneration: the blue mountains eye study.Arch ophthalmoI,2007,125:1089—1095.
[13] Schaumberg DA,Hankinson SE,Guo Q,et aI.A prospective study of 2 major age-related macular degeneration susceptibility alleles and interactions with modifiable risk factors. Arch Ophthalmol,2007,125:55-62.
[14] Mares JA, Moeller sM. Diet and age-related macular degeneration:expanding our view. Am J Clin Nutr,2006,83:733-734.
[15] SanGiovanni JP, Chew EY, Clemons TE, et al. The relationship of dietary lipid intake and age-related macular degeneration in a case-control study: AREDS report No. 20.Arch ophthalmol,2007,125:671-679.
[16] Chong Ew,Wong TY,Kreis AJ,et al. Dietary antioxidants and primary prevention of age related macular degeneration:systematic review and meta-analysis. BMJ,2007,355:755.
[17] Alves-Rodrigues A,Shao A.The science behind lutein.Toxicol Lett,2004,150:57-83.
[18] SanGiovanni JP, Chew EY, Clemons TE, et al. The relationship of dietary carotenoid and vitamin A,E,and C intake with age-related macular degeneration in a case-control study:AREDS No.22.Arch Ophtllalmol,2007,125:1225—1232.
[19] Haines JL,Hauser MA,Schmidt S,et al.Complement factor H variant increases the risk of age-related macular degeneration.Science,2005,308:419-421.
[20] Edwards AO,Ritter R, Abel KJ, et al.Complement factor H polymorphism and age-related macular degeneration.Science,2005,308:42-424.
[21] KIein RJ,Zeiss C,Chew EY,et al.Complement factor H polymorphism in age-reIated macular degeneration. Science,2005,308:385—389.
[22] Conley YP,Jakobsdottir J,Mah T,et al.CFH,ELOVL4 PLEKHA1 and LOC387715 genes and susceptibiIity to age-related maculopathy: AREDS and CHS cohorts and meta-analyses. Hum Mol Genet.2006,15:3206-3218
[23] 朱华丽,张明,张军军。补体因子H与老年性黄斑变性。中华眼底病杂志,2007,23:75—77.
[24] Li M,Atmaca-Sonmez P,0thman M,et al. CFH haplotypes without the Y402 H coding variant show strong association with susceptibility to age-related macular degeneration. Nat Genet,2006.38:1049-1054.
[25] Maller J,George S,Purcell S,et al.Common variation in three genes,including a noncoding variant in CFH,strongly influences risk of age-related macular degeneration. Nat Genet,2006,38:1055-1059.
[26] Gold B,Merriam JE, Zernant J,et al. Variation in factor B (BF) and complement component 2 (C2) genes is associated with Age-related macular degeneration. Nat Genet, 2006, 38: 458-462.
[27] Haddad S,Chen CA,Santangelo SL,et al.The genetics of age-related macular degeneration:a review of progress to date. Surv Ophthalmol,2006,51:316-363.
[28] Ross RJ,Verma V,Rosenberg KI,et al. Genetic markers and biomarkers for age-related macular degeneration. Expert Rev OphthaImol,2007,2:443-457.
[29] Yang Z,Camp NJ,Sun H,et al. A variant of the HTRA1 gene increases susceptibility to age-related macular degeneration.Science,2006,314:992-993.
[30] Dewan A, Liu M, Hartman S, et al. HTRA1 promoter polymorphism in wet age-related macular degeneration. Science,2006,314:989-992.
[31] Schmidt S, Hauser MA,Scott WK,et al. Cigarette smoking strongIy modifies the association of LOC387715 and age-related macular degcneration.Am J Hum Genet. 2006.78:852-864.
[32] Seddon JM,Francis PJ,George S,et al. Association of CFH Y402 H and LOC387715 A69S with progression of age-related macular degeneration.JAMA,2007,297:1793-1800.
[33] Francis PJ,George S,Schultz DW,et al. The LOC387715 gene, smoking, body mass index, environmental associations with advanced age-related macular degeneration. Hum Hered,2007, 63:212-218.
[34] Tammela T, Enholm B, Alitalo K, et al. The biology of vascular endotheIial growth factors. Cardiovasc Res,2005,65:550-563.
[35] Mahley RW. Apolipoprotein E: cholesterol transport protein with expanding roIe in cell biology.Science,1988,240:622-630.
[36] Baird PN, Guida E, Chu DT, et al.The epsilon2 and epsilon4 alleles of the apolipoprotein gene are associated with age-related macular degeneration. Invest Ophthalmol Vis Sci, 2004, 45:131l-1315.

